Chương 5. Đại cương cứng về kim loại
Lý thuyết về đại cương cứng kim loại
Chi tiếtChuyên mục: Chương 5. Đại cương về kim loại Được viết ngày thiết bị hai, 16 tháng 3 năm ngoái 15:28 Viết bởi Nguyễn Văn Đàm
Ở bài viết này bọn họ cùng tìm hiểu các vấn đề lý thuyết về sắt kẽm kim loại như vị trí của sắt kẽm kim loại trong bảng tuần hoàn, cấu trúc của nguyên tử kim loại, cấu trúc của tinh thể kim loại, links kim loại, đặc thù vật lý chung, tính chât hóa học phổ biến của kim loại, giải pháp điều chế kim loại, bào mòn kim loại..
I. VỊ TRÍ CỦA KIM LOẠI vào BẢNG TUẦN HOÀN
rộng 80% những nguyên tố chất hóa học là kim loại. Vào bảng tuần hoàn, sắt kẽm kim loại gồm:
- các nguyên tố s thuộc nhóm IA cùng IIA (trừ H, He).
Bạn đang xem: Lý thuyết đại cương về kim loại
- các nguyên tố p. Thuộc nhóm IIIA (trừ Bo), Sn, Pb (nhóm IVA), Bi (nhóm VA) cùng Po (nhóm VIA).
- toàn bộ các thành phần d (thuộc các nhóm B).
- toàn bộ các yếu tố f (thuộc chúng ta Lantan với họ Actini).
→ Kim loại tập trung ở phía dưới và phía trái của bảng tuần hoàn.
II. CẤU TẠO NGUYÊN TỬ KIM LOẠI
- Nguyên tử kim loại có không nhiều e ở phần bên ngoài cùng: thường từ một đến 3e.
- bán kính nguyên tử bự và năng lượng điện hạt nhân bé dại so với những phi kim trong cùng chu kì.
- năng lượng ion hóa thấp và độ âm điện nhỏ dại so với các phi kim cùng chu kỳ.
III. MẠNG TINH THỂ KIM LOẠI
1. Mạng tinh thể kim loại
- đa phần có cấu tạo đặc khít. Kim loại thường tồn tại bên dưới 3 hình dáng mạng là: lập phương chổ chính giữa diện (74%), lập phương chổ chính giữa khối (68%) và mạng lục phương (74%).
- Nút mạng là các cation hoặc nguyên tử kim loại dao động xung quanh địa chỉ nhất định.
- Giữa những nút mạng là tương đối nhiều các e có thể chuyển động tương đối trường đoản cú do.
2. Links kim loại
link kim loại là link sinh ra do các e tự do gắn những nút mạng với nhau.
IV. TÍNH CHÂT VẬT LÍ CỦA KIM LOẠI
1. Các tính chất vật lí chung
- sắt kẽm kim loại có đặc điểm vật lí phổ biến là dẻo, dẫn điện, dẫn nhiệt độ và tất cả ánh kim.
- Các đặc thù vật lí phổ biến này là do các e tự do thoải mái có vào mạng tinh thể kim loại gây ra.
2. Một số trong những tính chất vật lí khác
- Tỉ khối: của những kim một số loại rất không giống nhau nhưng thường dao động từ 0,5 (Li) mang lại 22,6 (Os). Thường xuyên thì:
+ d + d > 5: kim loại nặng (Zn, Fe...).
- ánh sáng nóng chảy: biến hóa từ -390C (Hg) đến 34100C (W). Thường thì:
+ t 0C: kim loại dễ nóng chảy.
+ t > 15000C: sắt kẽm kim loại khó rét chảy (kim các loại chịu nhiệt).
- Tính cứng: đổi khác từ mềm mang đến rất cứng.
Tỷ khối, nhiệt độ nóng chảy cùng tính cứng của kim loại phụ thuộc vào vào nhiều yếu tố như vẻ bên ngoài mạng tinh thể; mật độ e; cân nặng mol của kim loại...
V. TÍNH CHẤT HOÁ HỌC
đặc điểm hóa học của các kim nhiều loại là tính khử:
M → Mn+ + ne
1. Tính năng với phi kim
a. Với oxi
- hầu như các sắt kẽm kim loại đều gia nhập phản ứng trừ Au, Pt, cùng Ag → oxit bazơ hoặc oxit lưỡng tính.
2x
M + y
O2 → 2Mx
Oy
- nấc độ bội nghịch ứng với oxi của những kim một số loại khác nhau: kim loại càng khỏe khoắn thì bội nghịch ứng càng mạnh.
+ K, na cháy sinh sản thành oxit khi bao gồm lượng oxi hạn chế. Trường hợp oxi dư thì tạo thành peoxit.
+ Ca, Mg, Al, Zn, fe cháy tạo ra thành oxit và khả năng phản ứng với oxi sút dần.
+ những kim một số loại từ Pb → Hg ko cháy nhưng tạo thành thành màng oxit bên trên bề mặt.
+ các kim một số loại từ Ag → Au không cháy cùng không tạo ra thành lớp màng oxit bên trên bề mặt.
- phản bội ứng cùng với oxi của kim loại phụ thuộc vào vào bề mặt của lớp oxit tạo thành thành: nếu bề mặt không khít thì phản nghịch ứng hoàn toàn; nếu bề mặt khít thì chỉ phản nghịch ứng sống trên mặt phẳng như Al, Zn...
b. Với clo
các kim nhiều loại đều chức năng với clo khi đun nóng → muối clorua (KL có hóa trị cao).
2M + n
Cl2 → 2MCln
c. Với những phi kim khác
các kim các loại còn phản bội ứng được với nhiều phi kim khác ví như Br2, I2, S...
2Al + 3I2 → 2Al
I3 (H2O)
Fe + S → Fe
S (t0)
2. Chức năng với nước
a. Ở ánh sáng thường
- Chỉ có sắt kẽm kim loại kiềm với kiềm thổ như Na, K, cha và Ca bội nghịch ứng → kiềm + H2.
- bội nghịch ứng tổng quát:
2M + 2n
H2O → 2M(OH)n + n
H2
b. Phản nghịch ứng ở ánh nắng mặt trời cao
- Mg và Al tất cả phản ứng phức tạp:
Mg + 2H2O → Mg(OH)2 + H2 (1000C)
Mg + H2O → Mg
O + H2 (≥ 2000C)
- Mn, Zn, Cr, fe ở ánh nắng mặt trời cao phản ứng với tương đối nước → oxit kim loại + H2.
3Fe + 4H2O → Fe3O4 + 4H2 (0C)
Fe + H2O → Fe
O + H2 (> 5700C)
3. Chức năng với dung dịch axit
a. Với những dung dịch axit HCl, H2SO4 loãng, H3PO4... (H+)
Chỉ kim loại đứng trước H2 mới có phản ứng → muối (trong đó kim loại chỉ đạt ngưỡng đến hóa trị thấp) + H2.
Fe + H2SO4 loãng → Fe
SO4 + H2
Chú ý: Na, K, Ba, Ca… khi cho vô ddịch axit thì làm phản ứng với H+ trước, nếu như dư thì phản nghịch ứng cùng với H2O. Pb đứng trước tuy nhiên không công dụng với HCl với H2SO4 loãng do tạo muối khó tan bám trên mặt ngăn cản phản ứng.
b. Chức năng với dung dịch các axit gồm tính oxi hóa mạnh HNO3, H2SO4 đặc nóng
- Al, Fe, Cr thụ động với H2SO4 đặc nguội cùng HNO3 đặc nguội.
4. Chức năng với dung dịch muối
- với Na, K, Ca và ba phản ứng cùng với nước trước tiếp đến dung dịch kiềm tạo thành thành đang phản ứng với muối.
- Với những kim nhiều loại không tung trong nước, kim loại hoạt động (đứng trước) đẩy được kim loại kém chuyển động (đứng sau) ra khỏi dung dịch muối của chúng theo quy tắc α.
Fe + Cu
SO4 → Fe
SO4 + Cu
Chú ý:
2Fe3+ + Fe → 3Fe2+
Cu + 2Fe3+ → Cu2+ + 2Fe2+
Fe2+ + Ag+ → Ag + Fe3+
5. Phản bội ứng với hỗn hợp kiềm
- các kim loại tan vào nước: Na, K, Ca cùng Ba chức năng với nước bao gồm trong dung dịch.
- một trong những kim loại có hiđroxit tương ứng là hóa học lưỡng tính + dung dịch bazơ → muối + H2.
Al + H2O + Na
OH → Na
Al
O2 + 3/2H2
VI. ĐIỀU CHẾ KIM LOẠI
1. Cách thức nhiệt luyện
- Nguyên tắc: dùng chất khử CO, C, Al, H2 khử oxit sắt kẽm kim loại ở nhiệt độ cao.
- Phạm vi sử dụng: thường dùng trong công nghiệp với sắt kẽm kim loại sau Al.
2. Cách thức thủy luyện
- Nguyên tắc: dùng dung dịch thích hợp (HCl, HNO3, nước cường toan, CN-…) hài hòa nguyên liệu sau đó lấy sắt kẽm kim loại mạnh (không tan trong nước) đẩy kim loại yếu khỏi hỗn hợp của nó.
- Phạm vi sử dụng: hay được dùng trong chống thí nghiệm để điều chế những kim nhiều loại sau Mg (thường là sắt kẽm kim loại yếu).
Xem thêm: Cách In Tràn Lề Trên Máy In Canon, G5000 Series, G1010 Series : Thực Hiện In Không Viền
3. Phương thức điện phân
a. Điện phân nóng chảy
- Nguyên tắc: Dùng cái điện một chiều khử ion kim loại trong hóa học điện li rét chảy (muối halogenua, oxit, hidroxit).
- Phạm vi sử dụng: có thể dùng nhằm điều chế tất cả các sắt kẽm kim loại nhưng hay được sử dụng với kim loại mạnh: K, Na, Mg, Ca, cha và Al.
b. Điện phân dung dịch
- Nguyên tắc: Dùng dòng điện một chiều khử ion sắt kẽm kim loại yếu trong dung dịch muối của nó.
- Phạm vi sử dụng: cần sử dụng điều chế các kim loại yếu.
VII. ĂN MÒN KIM LOẠI
- Ăn mòn sắt kẽm kim loại là sự tàn phá kim các loại hoặc kim loại tổng hợp dưới chức năng của môi trường thiên nhiên xung quanh.
- Ăn mòn kim loại gồm làm mòn hóa học và làm mòn điện hóa.
1. Ăn mòn hóa học
- Nguyên nhân: do sắt kẽm kim loại có làm phản ứng hóa học trực tiếp với những chất ở môi trường xung quanh xung quanh.
- Điều kiện: kim loại được đặt trong môi trường xung quanh có đựng chất oxi hóa cơ mà kim loại có thể tham gia bội nghịch ứng hay là chất khí, khá nước, hỗn hợp axit...
- bản chất: là bội nghịch ứng thoái hóa - khử trong đó kim các loại đóng vai trò chất khử. Electron đưa trực tiếp từ sắt kẽm kim loại vào môi trường.
2. Ăn mòn điện hóa
- Ăn mòn năng lượng điện hóa là sự hủy hoại kim các loại hoặc kim loại tổng hợp do tiếp xúc với dung dịch chất điện li tạo cho dòng điện.
- Điều kiện xảy ra sự bào mòn điện hóa:
+ gồm 2 năng lượng điện cực khác biệt về thực chất (kim nhiều loại + kim loại; sắt kẽm kim loại + phi kim; sắt kẽm kim loại + thích hợp chất).
+ 2 điện cực đề nghị được tiếp xúc điện với nhau.
+ 2 điện rất cùng được tiếp xúc với dung dịch chất điện li (không khí ẩm).
- hiệ tượng của quy trình ăn mòn điện hóa:
+ kim loại mạnh đóng vai trò là cực âm (anot).
+ kim loại yếu hơn hoặc phi kim vào vai trò rất dương(catot).
+ Tại rất âm, sắt kẽm kim loại mạnh bị làm mòn (bị oxi hóa).
M → Mn+ + ne
+ Tại cực dương, môi trường xung quanh bị khử:
Môi ngôi trường axit:
2H+ + 2e → H2
Môi ngôi trường trung tính, bazơ:
2H2O + O2 + 4e → 4OH-
(phản ứng phụ): Mn+ + n
OH- → M(OH)n (tạo gỉ)
- thực chất của làm mòn điện hóa: là việc oxi hóa kim loại ở cực âm cùng sự khử môi trường ở rất dương. Electron được gửi từ kim loại mạnh sang kim loại yếu (hoặc phi kim) rồi vào môi trường.
3. Bảo đảm an toàn kim nhiều loại khỏi sự nạp năng lượng mòn
Để đảm bảo an toàn kim các loại khỏi sự nạp năng lượng mòn hoàn toàn có thể sử dụng các cách thức sau:
- bí quyết li sắt kẽm kim loại với môi trường: sơn, mạ, tráng, nhúng nhựa...
- cần sử dụng chất kìm hãm.
- Tăng khả năng chịu đựng: hợp kim chống gỉ.
- phương pháp điện hóa: dùng kim loại mạnh hơn kim loại ở rất âm không tác dụngvới nước gắn vào vật bị ăn mòn phần chìm ngập trong dung dịch năng lượng điện li (anot hi sinh).
Tổng hợp kim chỉ nan chương Đại cưng cửng về sắt kẽm kim loại đầy đủ, chi tiết nhất
Tài liệu Tổng hợp triết lý chương Đại cương về kim loại đầy đủ, cụ thể nhất Hoá học tập lớp 12 đã tóm tắt kiến thức và kỹ năng trọng trọng điểm về chương Đại cương cứng về kim loại từ kia giúp học sinh ôn tập để thế vứng kiến thức môn Hoá học lớp 12.

Tính hóa học của Kim loại: đặc điểm hóa học, đồ lí, Điều chế, Ứng dụng
1. Vị trí, cấu tạo của kim loại
a. Vị trí
- đội IA (trừ H), nhóm IIA: các kim loại này là phần nhiều nguyên tố s
- team IIIA (trừ B), một phần của các nhóm IVA, VA, VIA: những kim nhiều loại này là phần đa nguyên tố p
- các nhóm B (từ IB mang lại VIIIB): các kim nhiều loại chuyển tiếp, bọn chúng là hầu hết nguyên tố d
- họ lantan với actini (xếp riêng thành hai hàng ở cuối bảng): các kim một số loại thuộc nhì họ này là số đông nguyên tố f
b. Cấu tạo
- cấu tạo nguyên tử kim loại
+ số đông các nguyên tử kim loại có 1, 2 hoặc 3 electron ở phần bên ngoài cùng
+ nửa đường kính nguyên tử của các nguyên tố kim loại nhìn chung to hơn bán kính nguyên tử những nguyên tố phi kim
- cấu trúc mạng tinh thể kim loại
Có bố kiểu mạng tinh thể kim loại đặc trưng là lập phương trọng điểm khối, lập phương trọng điểm diện và lục phương
- link kim loại
Là liên kết hóa học tập hình thành vị lực hút tĩnh điện giữa ion dương sắt kẽm kim loại nằm ở các nút mạng tinh thể và những electron trường đoản cú do di chuyển trong toàn thể mạng lưới tinh thể kim loại.
2. Tính chất vật lý
- sắt kẽm kim loại có đặc điểm vật lí chung là dẻo, dẫn điện, dẫn nhiệt độ và bao gồm ánh kim.
- một trong những tính chất vật lí riêng:
* Tỉ khối: của những kim nhiều loại rất khác nhau nhưng thường giao động từ 0,5 (Li) cho 22,6 (Os). Hay thì:
+ d 5: kim loại nặng (Zn, Fe...).
* ánh nắng mặt trời nóng chảy: thay đổi từ -39o
C (Hg) đến 3410o
C (W). Hay thì:
+ t 15000C: sắt kẽm kim loại khó rét chảy (kim một số loại chịu nhiệt).
* Tính cứng: chuyển đổi từ mềm cho rất cứng.
Tỷ khối, ánh sáng nóng chảy và tính cứng của kim loại phụ thuộc vào nhiều yếu tố như dạng hình mạng tinh thể; mật độ e; trọng lượng mol của kim loại...
3. đặc thù hóa học
đặc điểm đặc trưng của sắt kẽm kim loại là tính khử (nguyên tử sắt kẽm kim loại dễ bị oxi biến thành ion dương): M → Mn+ + ne
a. Tính năng với phi kim
hầu như các sắt kẽm kim loại khử được phi kim điển hình thành ion âm
Ví dụ:
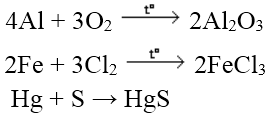
b. Tác dụng với axit
- Đối với dung dịch HCl, H2SO4 loãng:
M + n
H+ → Mn+ + n/2H2
(M đứng trước hiđro trong dãy thay điện rất chuẩn)
- Đối cùng với H2SO4 đặc, HNO3 (axit tất cả tính oxi hóa mạnh):
+ kim loại thể hiện các số oxi hóa không giống nhau khi phản bội ứng với H2SO4 đặc, HNO3 vẫn đạt số lão hóa cao nhất.
+ phần đông các kim loại phản ứng được với HNO3 với H2SO4 đặc (trừ Pt, Au)
lưu ý: Fe, Al, Cr bị bị động hóa trong H2SO4 và HNO3 sệt nguội.
khi ấy S+6 H2SO4 bị khử thành S+4 (SO2); So hoặc S-2 (H2S)
trong HNO3 đặc N+5 bị khử thành N+4 (NO2)
với HNO3 loãng N+5 bị khử thành N+2(NO); N+1 (N2O); No (N2); N-3 (NH4+)
+ các kim loại có tính khử càng mạnh khỏe thường cho thành phầm khử bao gồm số thoái hóa càng thấp. Các kim loại như Na, K... Sẽ gây ra nổ lúc tiếp xúc với các dung dịch axit
Ví dụ:
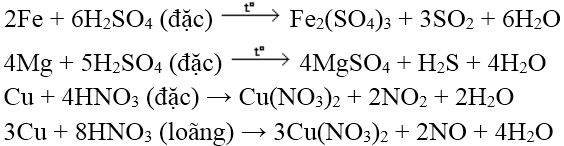
c. Chức năng với dung dịch muối
- với Na, K, Ca và cha phản ứng với nước trước kế tiếp dung dịch kiềm sinh sản thành đã phản ứng với muối.
- Với các kim nhiều loại không tung trong nước, kim loại hoạt động đẩy được sắt kẽm kim loại kém chuyển động ra khỏi hỗn hợp muối của chúng theo quy tắc α.
sắt + Cu
SO4 → Fe
SO4 + Cu
Chú ý:
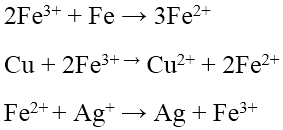
d. Tác dụng với dung dịch kiềm
các kim nhiều loại mà hiđroxit của chúng gồm tính lưỡng tính như Al, Zn, Be, Sn, Pb... Tác dụng được với hỗn hợp kiềm (đặc).
2Al + 6H2O + 2Na
OH → 2Na
e. Công dụng với oxit kim loại
những kim loại dũng mạnh khử được những oxit kim loại yếu rộng ở nhiệt độ cao thành sắt kẽm kim loại
Ví dụ:
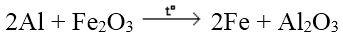
4. Điều chế
phép tắc điều chế: Khử ion kim loại thành kim loại
Mn+ + ne → M
* Một số phương thức điều chế
a. Cách thức nhiệt luyện
- Nguyên tắc: cần sử dụng chất khử CO, C, Al, H2 khử oxit sắt kẽm kim loại ở ánh nắng mặt trời cao.
- Phạm vi sử dụng: thường dùng trong công nghiệp với kim loại sau Al.
Ví dụ:
Pb
O + C → Pb + teo
Fe2O3 + 3CO → 2Fe + 3CO2
b. Phương pháp thủy luyện
- Nguyên tắc: cần sử dụng dung dịch thích hợp (HCl, HNO3, nước cường toan, CN-...) tổ hợp nguyên liệu kế tiếp lấy kim loại mạnh (không chảy trong nước) đẩy kim loại yếu khỏi hỗn hợp của nó.
- Phạm vi sử dụng: thường dùng trong phòng thí nghiệm để điều chế những kim các loại sau Mg (thường là sắt kẽm kim loại yếu).
Ví dụ:
xoàn lẫn trong khu đất đá có thể hòa tan dần trong hỗn hợp Na
CN với oxi của ko khí, được dung dịch muối phức của vàng:
4Au + 8Na
CN + O2 + 2H2O → 4Na
OH
Sau đó, ion Au3+ vào phức được khử bằng sắt kẽm kim loại Zn:
Zn + 2Na
c. Phương thức điện phân
- Điện phân nóng chảy
+ Nguyên tắc: Dùng mẫu điện một chiều khử ion kim loại trong chất điện li nóng chảy (muối halogenua, oxit, hidroxit).
+ Phạm vi sử dụng: hoàn toàn có thể dùng nhằm điều chế toàn bộ các sắt kẽm kim loại nhưng hay được sử dụng với sắt kẽm kim loại mạnh: K, Na, Mg, Ca, cha và Al.
- Điện phân dung dịch
+ Nguyên tắc: Dùng cái điện một chiều khử ion sắt kẽm kim loại yếu trong dung dịch muối của nó.








